脂質納米顆粒在當前SARS-CoV-2臨床試驗中的應用
1 BioNTech/輝瑞
BioNTech在SARS-COV-2試驗的遞送系統脂質成分主要是Acuitas的ALC-0315(表2)、DSPC、膽固醇和PEG-脂質。CureVac和倫敦帝國理工學院可能也使用ALC-0315或A9(表2)。BioNTech開始用四種mRNA編碼的免疫原開發SARS-CoV-2疫苗,其中兩種是核苷修飾的,一種是未修飾的,一種是自擴增的。
其中有關兩種核苷修飾的mRNA:BNT162b1是一種較短的、約1 kb的序列,其編碼刺突蛋白的受體結合結構域,由折疊三聚結構域修飾,通過多價顯示增加其免疫原性;
另一種BNT162b2是較長的、約4.3 kb的薛烈,其編碼二脯氨酸穩定的全長的膜結合刺突蛋白。BNT162b2最近獲得了歐盟和美國的緊急批準。在一項臨床前研究中,單次給藥0.2、1和5µg的BNT162b2后,可檢測到小鼠體內的結合抗體和中和效價,從**劑量到**劑量增加一個數量級,并在Th2細胞因子水平非常低的CD4+和CD8+脾細胞中引起強烈的抗原特異性Th1 IFNγ和IL-2反應。引流淋巴結也含有大量生發中心B細胞和CD4+和CD8+ T濾泡輔助細胞(Tfh)的數量也升高,這些細胞以前被認為是由mRNA LNP疫苗中LNP單獨誘導。
在非人的靈長類動物中,30 µg或100 µg的免疫增強劑量引起的結合抗體和中和效價是人類恢復期組的10倍以上,并產生強烈的Th1偏向性T細胞反應,這對預防疫苗相關的增強型呼吸道疾病很重要。在6只的獼猴中,兩次給藥100 µg后在支氣管肺泡灌洗液和鼻拭子中檢測不到病毒效價。對較小的mRNA編碼免疫原BNT162b1的1期臨床試驗中計劃在第1天和第21天給藥10、30和100 µg。中等劑量30 µg誘導的抗體結合和中和效價分別比人類恢復期組高30倍和3倍。由于第一次給藥后出現嚴重的注射部位疼痛,因此未給予100 µg劑量的增強劑量。給藥30 µg的增強劑量后100%的受試者產生輕度或中度的注射部位疼痛。第二次接種30 µg劑量后,幾乎所有受試者都經產生了輕度或中度的全身不良反應,如發熱、寒戰或疲勞。該試驗還證明了來自外周血單核細胞有強Th1偏向性T細胞反應。
一項2期臨床試驗比較了年輕(18-55歲)和年長(65-85歲)受試者組接種 BNT162b1和BNT162b2后的一些指標。老年組的結合和中和抗體效價略低,但仍高于恢復期組的受試者。與年輕組相比,老年組的不良反應嚴重程度也降低了。BNT162b2與BNT162b1相比,全身不良反應(發熱、寒戰、疲勞)的發生率**降低了約兩倍。正是BNT162b2耐受性的增加推動了其3期臨床試驗,最近該試驗宣布有效率達到94%,因為安慰劑組出現了162例感ran,而接受兩次30 µg劑量BNT162b2的接種組*發現8例感ran。
2 Moderna
在Moderna的研究中,核苷修飾的mRNA編碼的免疫原是一種跨膜錨定的二脯氨酸穩定的預融合刺突,具有天然的呋喃裂解位點,并以LNP遞送,該LNP參照MC3 LNP原型,但用脂質H (SM-102)替代MC3。mRNA LNP (mRNA-1273)接種劑量為1 µg而非0.1 µg,小鼠接種第1天和第21天,能誘導產生中和抗體。T細胞反應似乎是一種Th1/Th2平衡的反應,在小鼠的病毒模型中,兩次給藥1 µg(非0.1 µg)后,小鼠肺部和鼻甲的病毒效價降低到基線。以獼猴為實驗對象,兩次給藥劑量為100 µg,給藥后能產生高結合和中和效價以及在外周血中產生Th1偏向反應,同時也有強Tfh反應。兩次給藥10 µg劑量后效價和T細胞反應**降低。
同樣,100 µg劑量能夠將支氣管肺泡灌洗液和鼻拭子中的病毒效價降低到基線水平,而10 µg劑量*在肺部有效。在一項1期臨床研究中,每組15名患者,給藥頻率為間隔4周2次,給藥劑量為25、100或250 µg,100 µg劑量的結合和中和效價比恢復期高約10倍,相當于25 µg的恢復期。所有受試者在100 µg和250 µg劑量下均產生了不良反應,250 µg組的14名受試者中有3名發生了嚴重的不良反應,并被停藥。在隨后對老年患者(56-71歲和71歲以上)進行的1期臨床研究中,發現25 µg和100 µg劑量產生的結合抗體效價高于恢復期血漿中的,而中和效價與100 µg相當,但低于恢復期的25 µg。
即使是在老年組也有約80%的患者在第二次接種疫苗后仍出現不良反應。外周血分析顯示CD4 T細胞反應是Th1偏向型的。與25 µg劑量相比,100 µg劑量的中和效價更高,因此進一步進行了3期臨床試驗,中期結果顯示,安慰劑組出現了90例感ran,而接種疫苗組只有5例感ran,防護有效率達到94.5%。一**委員會對Moderna的3期臨床試驗的中期分析結果表明,出現嚴重不良反應包括:9.7%的接種者出現疲勞、8.9%的接種者出現肌肉疼痛、5.2%的接種者出現關節tong、4.5%的接種者出現**,而在輝瑞/BioNTech的3期臨床試驗中,出現疲勞的頻率較低,只有3.8%,**為2%。
3 CureVac
CureVac mRNA LNP (CVnCoV)采用的是一種非化學修飾的、序列工程mRNA,它編碼一種二脯氨酸穩定的全長的S蛋白,采用Acuitas LNP遞送技術,可能使用可電離脂質ALC-0315。小鼠實驗中劑量為2 µg時,對兩次給藥之間的周數(從1到4不等)進行了研究,發現較長的時間間隔在Balb/c小鼠中產生更高的效價和T細胞反應以及平衡的Th1/Th2反應。產生中和抗體需要第二次給藥,兩次給藥0.25 µg不足以產生中和抗體。在敘利亞金黃地鼠實驗中,兩次給藥10 µg (非2 µg)能夠將肺(非鼻甲)中的病毒效價降低到基線。在劑量為2-12 µg的1期臨床試驗中,*在**劑量12 µg時發現中和效價達到恢復期血清水平,這使得較高劑量(16和20 µg)被納入正在進行的2期臨床試驗。所有給藥劑量為12 µg的患者在每次給藥后都產生了全身不良反應,大多數為中度和重度,而> 80%的患者在局部注射部位產生了輕度和中度疼痛。
4 TranslateBio
Translate Bio使用的是一種非修飾的mRNA,其編碼雙突變的二脯氨酸穩定的刺突蛋白,采用LNP技術平臺,使用可電離脂質C12-200,C12-200很可能是近期的基于ICE-或半胱氨酸的可電離脂質家族合成的候選物。在Balb/c小鼠實驗中,發現在0.2-10 µg范圍內兩次給藥使結合和中和效價遠高于恢復期水平。在非人的靈長類動物實驗中,15、45和135 µg劑量均產生超過人類恢復期的效價,并且其免疫反應也是Th1偏向型的。
5 Arcturus
Arcturus使用的是一種自擴增的、全長的、未修飾的mRNA,其編碼融合前SARS-CoV-2全長的刺突蛋白,該LNP中使用帶有硫酯的可電離脂質,通過兩個額外的酯基將含胺的頭部和脂質尾部相連接。這個脂質家族中兩種可能的可電離脂質是脂質10a(在[111]的表4中)或脂質2,2 (8,8) 4CCH3(在[57]的第33頁上)(表2)。
后者有三個分支,類似于Moderna脂質H,但有一個可降解的硫酯連接到頭部。自擴增mRNA的一個特征是熒光素酶基因的表達在肌肉注射給藥一周后保持在相當恒定的水平,而常規mRNA的表達則迅速下降。在C57BL/6小鼠中,單獨接種疫苗使體重減輕和臨床評分增加。在具有高水平抗原特異性T細胞反應的Th1偏向反應中,只需要對小鼠以2 µg或10 µg(非0.2 µg)的劑量單次給藥,就可以使中和效價達到100以上。在K18-hACE2小鼠致死模型中,單次給藥2 µg或10 µg也可以100%保護小鼠,并且小鼠體重沒有減輕,且肺和腦的病毒效價降低到基線。Arcturus已經完成了接種劑量為1-10 µg的1期臨床試驗,并選擇使用7.5 µg作為接種劑量進行3期臨床試驗。
6倫敦帝國理工學院
倫敦帝國理工學院使用了一種由Acuitas LNP技術遞送的、自擴增的編碼預融合的穩定的刺突蛋白的mRNA,該蛋白在由脂質A9的**中有所描述(表2)。在Balb/c小鼠中兩次注射0.01 µg至10 µg的劑量后,產生了非常高的劑量依賴性抗體和中和效價。該反應是強Th1偏向型,與較低的0.1和0.01 µg劑量相比,10和1 µg的劑量產生了高三倍的抗原特異性脾細胞反應。該疫苗即將開始1期臨床試驗。
7 朱拉隆功大學,賓夕法尼亞大學
朱拉隆功大學與賓夕法尼亞大學合作,使用Genevant LNP技術開發一種天然刺突免疫原核苷修飾的mRNA LNP,采用的脂質可能是CL1。他們的目標是于2021年第一季度開始第一階段臨床試驗,并于2021年第四季度開始向泰國和七個周邊中低收入國家供應疫苗。
8 Providence Therapeutics
Providence Therapeutics獲得了加拿大衛生部的授權通知,可以對疫苗進行人體臨床試驗。對編碼受體結合域(具有或不具有呋喃裂解位點突變的全長刺突蛋白)的三種候選mRNA進行臨床前研究,按照免疫增強方法以C57BL6小鼠為實驗對象以20 µg的劑量給藥。
該疫苗使用來自Genevant的未公開脂質(可能與表2中的CL1相似)的臨床前數據,顯示出全長的和呋喃突變的有效載荷具有強大的中和效價。第一階段臨床試驗計劃于2021年第一季度開始,同時疫苗的生產和銷售計劃于同年獲得監管機構的批準。
9 儲存和供應
實驗室制造的大多數RNA LNP可以在4℃下保存幾天,但隨后出現顆粒尺寸增加和生物活性逐漸喪失(如熒光素酶表達)的特點。在以前的siRNA LNP方中,通常由于LNP聚集導致尺寸隨著時間增大。為了mRNA LNP疫苗能穩定的儲存和供應,需要采用冷凍形式。Moderna的疫苗需要在-25℃至-15℃之間儲存,在2℃至8℃之間可穩定儲存30天,在8℃至25℃可穩定儲存12小時。
輝瑞/BioNTech的疫苗需要在-80℃至-60℃之間儲存,解凍之后在2℃至8℃之間儲存最多5天,然后在注射前用鹽水稀釋。在儲存和運輸過程中,輝瑞疫苗所需的極低溫度比Moderna疫苗所需的常規冷凍溫度更難達到。這些溫度差異背后的原因并不明顯,因為兩種疫苗都含有類似的高濃度蔗糖作為冷凍保護劑。Moderna的mRNA LNPs被冷凍在Tris和醋酸鹽兩種緩沖液中,而輝瑞/BioNTech疫苗*使用磷酸鹽緩沖液。磷酸鹽緩沖液不適合冷凍,因為它們容易沉淀而且結晶會引起pH突變。凍干工藝對mRNA LNPs來說是一個技術難點。然而,Arcturus已經聲明,他們的mRNA疫苗在凍干形式中是穩定的,盡管這種凍干制劑的溫度穩定性尚未公開,但這可能會**簡化供應。
脂質納米顆粒
許多脂質樣實體,稱為脂質類化合物類脂,最初是為siRNA遞送而開發的,隨后用于mRNA遞送。C12-200就是一個例子(表2),由于其通過靜脈給藥在肝細胞基因沉默中的高效性,而在類脂家族中脫穎而出。為了實現高效的肝臟靶向基因沉默,C12-200與MC3 Onpattro原型相同的脂質相結合,即50%可電離脂質、10% DSPC、38.5%膽固醇和1.5% PEG-脂質。
后來的一項研究發現,通過將可電離脂質的百分比降低到35%,同時將可電離脂質與核酸的重量比從5增加到10,并用促細胞融合的不飽和DOPE取代DSPC,可以將C12-200對同一肝臟靶點的mRNA遞送效率提高7倍。
有趣的是,這種優化的方將mRNA表達提高了7倍,但沒有改變siRNA的沉默效率。在這種方中,C12-200也被研究用于小鼠和非人靈長類動物的mRNA介導的蛋白質替代療法,但是當皮下注射時,通過組織學觀察,它會產生強烈的炎癥反應。C12-200是一種小分子樹狀聚合物,具有五個烷基鏈和五個氮原子,根據ACDLabs Percepta等商用軟件進行電離分析,發現其中三個似乎是可質子化的(表2)。另一種樹枝狀大分子脂質,5A2-SC8,在觀察過程中發現對肝臟具有高siRNA傳遞效率,并且還具有五個氮原子和五個短烷基鏈(表2)。
類脂5A2-SC8對于mRNA遞送的效率很低,除非通過將可電離的脂質摩爾分數降低到24%,使用DOPE代替DSPC,并增加其他脂質比例來改變其方參數,但是同時5A2-SC8與mRNA的重量比將增加到20。
這些方的改變似乎是這些樹枝狀大分子型類脂成為有效的mRNA遞送載體所必需的,這可能是因為它們具有多質子的頭部和樹枝狀大分子結構。另一種非常高分子量的修飾樹枝狀大分子被用于遞送編碼流感、埃博拉和弓形蟲免疫原的自擴增mRNA,并且在小鼠實驗中,在單次給藥40 µg的高劑量或免疫增強方法注射4 µg后(這對復制RNA也是高劑量),發現可以避免三種病原體的感ran。最近對類脂進行研究發現,與其他類脂相比,這種小的三氮樹枝狀大分子的四個烷基鏈末端增加一個碳支鏈,肝臟表達能力提高了10倍以上。
這種效價的增加與LNP的pKa值沒有相關性,但與pH為 5時TNS染料的**熒光有相關性,這表明內涵體質子化的幅度與mRNA表達相關,推測可能是促進內涵體逃逸。根據分子形狀假說,增加的碳支鏈也可以產生一個更錐形的結構,從而產生更多的膜破裂。
編碼抗體基因的mRNA LNP的遞送
目前市場上有70多種單克隆抗體(mAbs),全球銷售額為1250億美元。使用mRNA編碼的抗體具有以下優勢,包括有益于天然翻譯后修飾的內源性蛋白質合成,以及是一種不需要細胞培養和對蛋白質產品大量純化和表征的簡化生產方法。通過將編碼VRC01(一種針對HIV-1的中和抗體)輕鏈和重鏈的純化核苷修飾的mRNA包封到Acuitas LNPs中,顯示出遞送mRNA編碼的mAbs可能用于被動免疫。
以 Balb/c小鼠為實驗對象,靜脈注射30 µg mRNA LNP(靶向肝細胞),表達mAbs超過一周,血清水平達到150 µg/ml,高于直接注射600 µg mAbs,每周注射能夠保持血清水平在40 µg/ml以上。CD34-NSG人源化小鼠注射30 µg和15 µg的mRNA LNP可以抵御24小時后的HIV-1攻擊,入侵2周后的血清病毒RNA復制分析也證明這一觀點。
CureVac的一項研究證實了**性非修飾mRNA編碼抗體的可行性,該研究也使用了Acuitas LNPs,其中選擇了對多種狂犬病毒株具有**中和能力的IgG mAbs,以及針對肉毒桿菌**的純重鏈Vh結構域(VHH)中和劑。還生產了一種靶向CD20的、mRNA編碼的利妥昔單抗,其中CD20是非霍奇金淋巴瘤**的**。
動物實驗通過靜脈注射使用的是靶向肝細胞的Acuitas LNP。小鼠單次給藥40 µg產生的血清抗體水平剛剛超過10 µg/ml,1個月后逐漸下降到1 µg/ml。相同劑量下,VHH單結構域中和劑產生的抗體水平高10倍,但由于缺乏Fc區,半衰期*有幾天。當在狂犬病病毒的致命攻擊之前1天或之后2小時,對小鼠單次靜脈注射40 µg也能夠*保護小鼠。
同樣,在致命的肉毒桿菌**攻擊后6小時單次給藥40 µg也*保護了動物。第三個攻擊模型是將Raji-luc2 B細胞淋巴瘤細胞靜脈移植并且生長4天,然后在18天內,在Acuitas LNP中5次給藥10或50 µg mRNA編碼的利妥昔單抗,結果是保護了所有動物,并且50 µg劑量能夠*消除**生長。
將T細胞募集到**細胞的雙特異性抗體也被編碼在修飾的mRNA結構中,并使用商業轉染試劑TransIT在體內遞送,該試劑在肝臟遞送方面不如目前的LNP有效。
該mRNA結構可維持循環和生物活性的雙特異性抗體超過6天,而相同5 µg劑量的蛋白質-雙特異性抗體在**后減少至接近基線。第二項研究也是使用VHH形式的雙特異性抗體進行的,其中一個結合保守的甲型流感基質蛋白2外域(M2e)的VHH基因與另一個小鼠Fcγ受體IV (FcγRIV) 特異性結合的VHH基因相連,以便將表達FcγRIV的先天免疫細胞募集到表達M2e的流感感ran細胞中。
這些核苷修飾過結構的mRNA使用DOTAP/膽固醇制備的LNPs遞送,通過氣管內滴注到小鼠肺中,4小時后,用致死劑量的流感病毒攻擊,80%的小鼠免受致死劑量的影響,盡管它們產生明顯的體重減輕,并且DOTAP/膽固醇mRNA納米粒導致粒細胞暫時流入肺部,同時血清IL-6細胞因子水平也有所升高。
**,在基孔肯雅感ran幸存者的B細胞中發現的一種有效中和抗體被編碼在一種核苷修飾的mRNA結構中,該結構由一個可能含有MC3或脂質5的LNP遞送。靜脈注射0.5 mg/kg(10 µg)編碼mAb的mRNA,24小時預注射的小鼠獲得了抗病毒攻擊的保護作用,而注射蛋白mAb需要2 mg/kg的劑量。在感ran后4小時,對小鼠注射高劑量10 mg/kg (200 µg),使小鼠避免感ran。非人的靈長類動物研究中發現,3 mg/kg(9 mg)的高劑量產生的短暫毒性(包括脾臟增大和CCL2血清水平升高)最小,且注射后幾個月仍可檢測到抗體。基于這些結果,Moderna啟動了一項1期臨床試驗,并公布了陽性結果,其中0.1和0.3 mg/kg的劑量耐受性良好,并且mAb的血清水平在1–14 µg/mL的范圍內,預計單次給藥后可對基孔肯雅病毒具有長達16周的免疫作用。
脂質納米顆粒組裝和結構
目前mRNA脂質納米顆粒的生產方法是利用微流體或T型接頭,把含有疏水性質的乙醇相和含有mRNA的水相在pH為4的緩沖液(如乙酸)中混合(圖2)。現有的方法(如薄膜蒸發法和乙醇注入法),由于納米粒子粒徑不穩定、mRNA包封率較低、難以擴大規模而很少使用。微流體混合的優點是能夠將乙醇中非常小體積的脂質與幾十µL水溶液中的mRNA混合,從而可以篩選許多成分和方參數。另一方面,T型接頭混合器是大批量商業生產mRNA LNPs的通用方法,例如目前臨床試驗中使用的方法。
最近的一份期刊表明,這兩種方法都可以生產有類似大小和形態的LNP。兩種溶液的快速混合是控制粒徑< 100 nm的關鍵,從而避免了其他生產方法所需的尺寸減小的需要(擠出、超聲處理)。如圖2所示,由這些溶液組裝和形成LNP的過程是由疏水力和靜電力驅動的。四種脂質(可電離脂質、DSPC、膽固醇、PEG-脂質)最初可溶于乙醇,可電離脂質非質子化且呈電中性(圖2A)。通常將一體積的含脂質的乙醇溶液與三體積的mRNA在pH=4的醋酸鹽緩沖液中混合,這使得脂質接觸緩沖液時,它們變得不溶于3∶1的水/乙醇溶劑,并且可電離的脂質質子化攜帶正電荷,然后與mRNA的帶負電荷的磷酸骨架靜電結合(圖2B),形成包封mRNA的脂質顆粒,同時脂質在主要是水的懸浮液中變得難溶。
這一過程中的一個關鍵成分是PEG-脂質,因為PEG鏈是親水性的,從而包覆顆粒,并決定其最終的熱力學穩定尺寸大小。通過改變PEG的摩爾分數,可以控制LNP的大小,例如,LNP顆粒大小為100 nm時PEG-脂質的摩爾分數為0.5%,而43 nm時PEG-脂質的摩爾分數為3%。最近一個研究顯示,當mRNA LNP懸浮液在水溶液緩沖液中稀釋或透析以提高pH并去除乙醇時,LNP的結構和大小在混合后繼續發生變化。水相和脂質相混合時初始pH值接近5.5,使可電離脂質質子化,其LNP的pKa接近6.5,可以與mRNA結合和包裹(圖2B,C)。
之后通過稀釋、透析或切向流過濾提高pH可以中和可電離脂質,直到pH為7.4時可電離脂質基本不帶電(圖2D)。當可電離脂質變為電中性時,它也變得更難溶解,導致形成更大的疏水類脂結構域,從而促進LNP的融合,使LNP的尺寸增大,LNP的中心形成無定形的電子致密相,主要包含與mRNA結合的可電離脂質。據估計,在這個過程中,多達36個囊泡可以融合形成最終的LNP(圖2C,D)。使用FRET對證實了這一融合過程,并進一步看到了PEG-脂質在這一過程中的作用,因為混合后加入PEG-脂質與混合前加入PEG-脂質以相同的方式控制最終LNP的大小。這項研究和另一項使用中子散射方法的研究也表明,DSPC在LNP的**PEG層的下面形成了一個雙層結構,其**主要是與mRNA結合的可電離脂質(圖2D),同時認為膽固醇分布在整個LNP中。
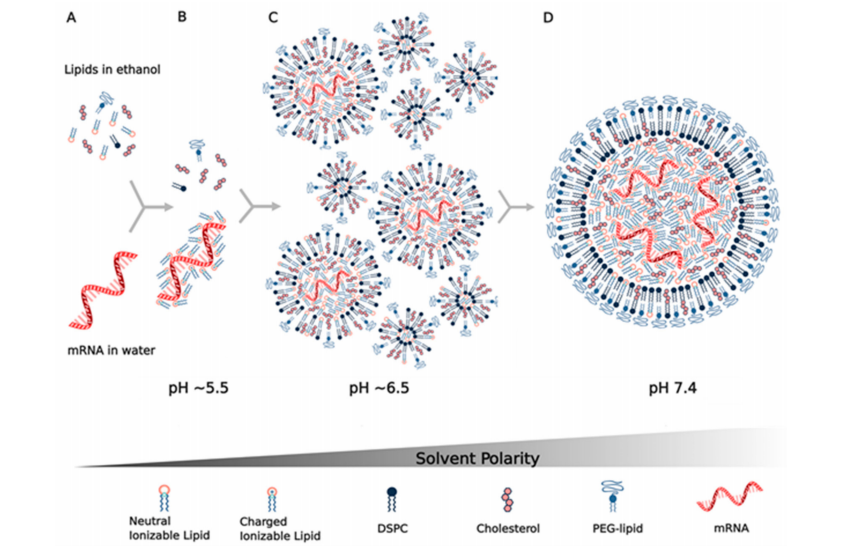
圖2:mRNA脂質納米顆粒的組裝是通過(A)在微流體或T型接頭混合器中將四種脂質(可電離脂質、DSPC、膽固醇、PEG-脂質)在乙醇中與mRNA在pH4左右的水溶液緩沖液中快速混合而實現的。
(B)當可電離脂質與水相接觸時,在pH~5.5范圍內質子化,該pH介于緩沖液的pKa和可電離脂質的pKa之間。
(C)可電離脂質與mRNA的陰離子磷酸骨架靜電結合,同時它在水相中經歷具有疏水性,驅動囊泡的形成和mRNA的包裹。
(D)在初始囊泡形成后,通過稀釋、透析或過濾提高pH,中和可電離脂質,使其疏水性增強,從而驅動囊泡融合,導致可電離脂質與mRNA進一步包裹在脂質納米粒的內部。通過給LNP提供親水性的外表、確定其熱力學穩定的尺寸大小,PEG-脂質的含量停止融合,在PEG-脂質層的下面形成DSPC的雙層結構。